CAR-T作为一项划时代的癌症疗法,其优异疗效已经在一些血液瘤中得到了充分证明,然而,较为严重甚至可能致死的副作用细胞因子综合征(CRS)和神经毒性等问题仍然是需要迈过去的坎,不单单是副作用本身可能带来的危害,处理副作用需要花费的药物成本管理也对CAR-T治疗造成了很大的障碍。
近日,来自宾夕法尼亚大学米切尔实验室的研究团队可能为CAR-T的CRS问题提供解决方案——给CAR-T穿上一件聚乙二醇“盔甲”,通过这种方式来避免单核细胞与其的作用。
相关成果发表于Nature子刊Nature materials上,论文的第一作者为米切尔实验室的博士后研究员Ningqiang Gong。
CRS问题可能来自于巨噬/单核细胞
严重的CRS通常在注射CAR T细胞后一天内出现,症状包括高烧、呕吐、心血管和呼吸功能不全。如果不进行治疗,这可能导致多器官功能障碍或患者死亡。CRS还伴有神经毒性。然而,神经毒性通常在CRS相关症状消失后延迟数周,并可能导致患者死亡。
在对CRS的临床管理中,中度到重度通常采用抗IL-6受体(IL-6R)抗体Tocilizumab和糖皮质激素进行免疫抑制,但是Tocilizumab却在预防神经毒性方面却没有作用。
而在引起CRS的细胞因子中,起到主要作用的IL-1和IL-6两种主要都是由单核细胞/巨噬细胞(巨噬细胞∈单核细胞)产生的。但是偏偏CAR-T的治疗还无法离开单核细胞,一些研究发现,它们同时对CAR T细胞介导的毒性和肿瘤细胞杀伤至关重要。
虽然至关重要,但物极必反,CRS可能是由此产生的。
研究还表明,CRS期间单核细胞的过度活化是不必要的CAR T细胞-单核细胞相互作用的结果。例如,T细胞表面蛋白CD40 L,CD69,淋巴细胞激活基因和膜表达的TNF-α可以通过细胞间相互作用机制激活单核细胞和巨噬细胞。而受到刺激的单核细胞和巨噬细胞就可能产生众多的细胞因子。
因此,通过控制CAR T细胞-单核细胞的相互作用来减少单核细胞的过度活化可以为CRS和神经毒性的治疗提供一个潜在的解决方案。
通俗地来讲,就是让单核细胞“你别急”。
“叠甲”以避免单核细胞与CAR-T发生作用
之所以采用聚乙二醇(PEG)作为“甲”来叠,是因为PEG是一种已经被FDA批准用于各种生物医学应用的生物材料。
首先为了更好地进行代谢标记,研究人员通过叠氮聚糖(四酰化的N-叠氮乙酰甘露糖胺)去培养CAR T细胞,然后将代谢标记的CAR-T和二苯并环辛烯(DBCO)修饰的PEG——DBCO-PEG结合,DBCO-PEG在培养条件下或动物体内与CAR T细胞表面的叠氮基团发生反应,得到了DBCO-PEG修饰的CAR T细胞,而其中分子量为600kDa的DBCO-PEG修饰的CAR T细胞基本上阻断了所有细胞间的相互作用,并降低了体外单核细胞的活化和细胞因子的释放。
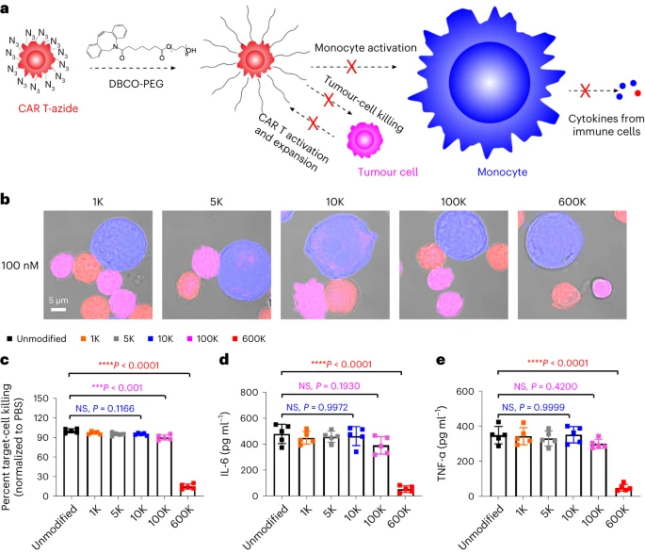
与一般的CAR-T相比,在第10天收集的DBCO-PEG修饰CAR T细胞并没有诱导肿瘤细胞杀伤和细胞因子(IL-6、IL-1、TNF-α)释放,然而,在第15天和第20天收集的CAR T细胞却诱导了大量的靶细胞杀伤和细胞因子释放。
研究人员认为,是因为DBCO-PEG600K逐渐在CAR-T细胞表面稀释,使得细胞之间的作用慢慢恢复。
有趣的是,第15天CAR-T诱导的并没有CRS的元凶IL-6和IL-1,但确实诱导了大量的肿瘤细胞杀伤和CAR T细胞相关细胞因子TNF-α的释放。
CAR-T细胞在体内的扩增高度依赖于肿瘤细胞的识别,然而DBCO-PEG600K修饰的CAR T细胞却阻断了这一路径,肿瘤细胞并不能做到诱导这一CAR-T迅速扩增,而是随着PEG的逐步稀释缓慢扩增。由于CAR T细胞-肿瘤-细胞相互作用比CAR T细胞-单核细胞相互作用恢复得早,这一做法能够令单核细胞被活化之前就能够让CAR-T去杀死肿瘤细胞。
值得一提的是,相比于IL-6R单抗,“叠了甲”的DBCO-PEG600K修饰的CAR T还能够有效减轻神经毒性,因为IL-1是诱导神经毒性的主要细胞因子,由于DBCO-PEG600K并没有诱导IL-1这使得神经毒性得到了减轻。
另外,研究人员还证明,四嗪(Tz)-反式环辛烯(TCO)也可以用于修饰材料,而相比于DBCO-PEG600K和Tz-PEG 1k,Tz-PEG600K的对于神经毒性的减弱效果更好。
研究人员表示,他们建立了一个减少副作用的CAR-T系统,当给予CAR T-叠氮细胞后,可以根据需要添加聚合物间隔物——因此,除非患者出现严重的CRS症状,否则肿瘤杀伤能力不会减弱。
当然这种叠甲法本身也有点不足之处,毕竟PEG本身也有免疫原性。
研究人员认为,由于PEG的使用可能在体内诱导抗PEG抗体的产生,未来的工作将评估不同聚合物的原位结合或纳米/微米颗粒作为控制CRS和神经毒性的替代“隔离剂”。
总结
从思路来看,此前有研究想要通过在CAR-T上加装CD47来避免CAR-T被巨噬细胞“吃掉”,而此次研究则通过为CAR-T叠甲来做到缓慢释放的效果,可以说是为了应对CAR-T的各种问题采取了各种不同的思路和技巧,期望这项研究能够在CAR-T的实际临床转化中添砖加瓦。
参考来源:https://medicalxpress.com/news/2023-09-technique-car-therapies-cancer-cells.htmlGong, N., Han, X., Xue, L. et al. In situ PEGylation of CAR T cells alleviates cytokine release syndrome and neurotoxicity. Nat. Mater. (2023). https://doi.org/10.1038/s41563-023