自从别吃我信号通路“CD47-SIRPα”被发现以来,CD47通常被作为抑制剂开发,无论是CD47单抗还是SIRPα单抗,都是旨在阻断“CD47-SIRPα”信号,使得巨噬细胞能够识别肿瘤细胞。
而以Juno原班人马为基石打造的CAR-T疗法公司Sana Biotechnology,则正面利用CD47帮助实现免疫逃逸的能力,用于开发CAR-T细胞,以克服异体细胞的免疫原性挑战。
CAR-T细胞治疗已经在肿瘤治疗中显示出积极临床获益,但是昂贵的价格限制了CAR-T的可及性。
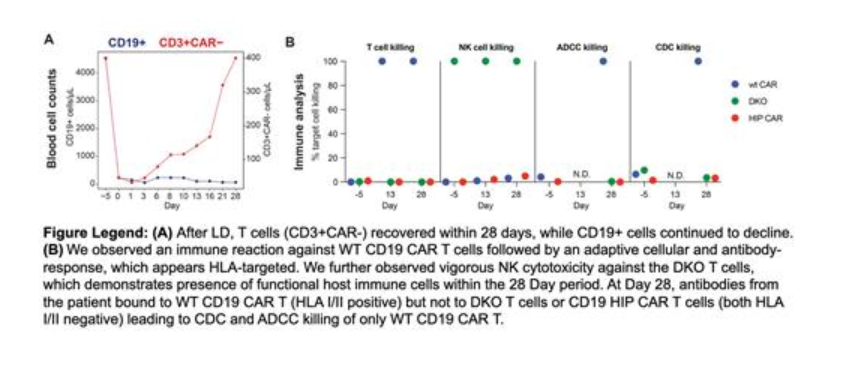
因此,同种异体/Off the Shelf CAR-T就应运而生。但同种异体CAR-T存在两大挑战,一个是免疫原性,一个是治疗效果。延伸阅读:疗效留不住的通用细胞疗法针对免疫原性的问题,现在大多开发者都是通过利用基因编辑工具,敲除或沉默HLA、TRAC等会引起免疫排斥的基因。Sana公司的低免疫(HIP)平台同样破坏MHC I和MHC II表达,以允许异体细胞逃避适应性免疫系统(包括抗体和T细胞反应);此外还通过基因工程使其过表达CD47,以实现对先天免疫系统的逃逸(包括巨噬细胞和NK细胞)。相关临床前研究表明,HIP CAR-T能够在保持活性的同时,实现对先天性免疫系统和适应性免疫系统的逃逸。目前,Sana公司基于HIP平台开发了多款在研管线,包括同种异体CD19 CAR-T、同种异体CD22 CAR-T、针对B细胞介导的自免疾病的同种异体CAR-T、以及针对1型糖尿病患者的干细胞衍生胰岛细胞。日前,Sana公司在期刊Blood上发表了其低免疫(HIP)平台异体CAR-T细胞SC291的首例患者初始数据。SC291来源于健康供体的CD4+和CD8+ T细胞,通过基因工程破坏CD3和HLA I/II类的功能,同时过表达CD47,以及携带CD19 CAR。SC291是一种T细胞混合物,存在许多T细胞亚群,包括完全HIP工程CD19 CAR-T(CD19 HIP CAR-T)、无CD47过表达的HLA I/II阴性T细胞(DKO)、HLA I/II阳性且过表达CD47的CAR-T细胞(WT CD19 CAR T)等等。一名74岁的慢性淋巴细胞白血病(CLL)男性患者,此前接受了三线治疗(FCR、依鲁替尼、venetoclax+利妥昔单抗),患者先接受环磷酰胺和氟达拉滨的清淋(lymphodepletion,LD)治疗,然后接受剂量为6千万的SC291输注(其中约80%是完全HIP工程细胞,其余包括未完全HIP工程细胞)。数据报告显示,SC291的耐受性良好,没有观察到CRS或ICANS。患者在LD后,SC291输注前发生中性粒细胞减少热。在SC291输注后的第28天,患者出现部分缓解,同时B细胞显著减少(99%),血小板水平改善。细胞动力学分析正在进行中。临床数据证明了SC291在初始患者中的初步安全性和耐受性。研究团队采取了该患者在SC291治疗前5天(-5天)、治疗后第13天和第28天的血液样本,并将患者的PBMC分为CD3+ T细胞和CD3- CD56+ NK细胞,并与CD19 HIP CAR-T、DKO、WT CD19 CAR-T三种亚群细胞共孵育,对SC291的免疫逃逸情况进行评估。在-5天时,T细胞EliSpot检测显示对任何SC291亚群细胞都没有免疫反应。但在第13天和第28天,检测出针对WT CD19 CAR-T细胞的高且增加的IFN-g水平;T细胞毒性实验也显示出类似的结果。DKO和CD19 HIP CAR-T细胞在任何时间点均未观察到T细胞活化和T细胞杀伤。第-5天没有检测到针对任何分类亚群的抗体,但在第28天观察到WT CD19 CAR-T细胞与IgG抗体结合;与DKO和CD19 HIP CAR-T细胞不结合,且没有CDC或ADCC反应。意味着,破坏HLA I/II表达,能够帮助T细胞逃逸来自适应性免疫的攻击。数据显示,所有时间点上,NK细胞都攻击杀伤了DKO细胞,但保留了CD19 HIP CAR-T和WT CD19 CAR-T。
意味着,CD47的过表达,能够帮助治疗性T细胞逃逸来自NK细胞的先天免疫系统攻击。以上结果表明,CD19 HIP CAR-T能够有效逃避宿主的适应性和先天性免疫反应,克服同种异体细胞治疗的免疫屏障。
此外,在使用LD方案时候,研究人员还观察到CD19+细胞在第0天和第28天分别减少95%和99%,而T细胞从第0天减少88%反弹到第28天的预处理水平。自从别吃我信号通路“CD47-SIRPα”被发现以来,CD47通常被作为抑制剂开发。但随着时间的发展,CD47仍是尚未成药的靶点,加上CD47开发难度高,以及CD47药物的红细胞凝集副作用——CD47项目纷纷折戟。而利用CD47帮助CAR-T实现免疫逃这一种新用法,如果能够得到验证,CD47可能之后会迎来新的开发机会。