由于阿尔茨海默病(AD)的发病率不断增加,目前已经进行了大量的研究,以寻找能够改变疾病进程、产生药理治疗效果的药物。然而,目前还没有治愈AD的根本方法。目前在AD治疗中获得批准的药物只能用于缓解AD症状,主要限于乙酰胆碱酯酶抑制剂、Aβ单克隆抗体和NMDA受体拮抗剂(表1)。
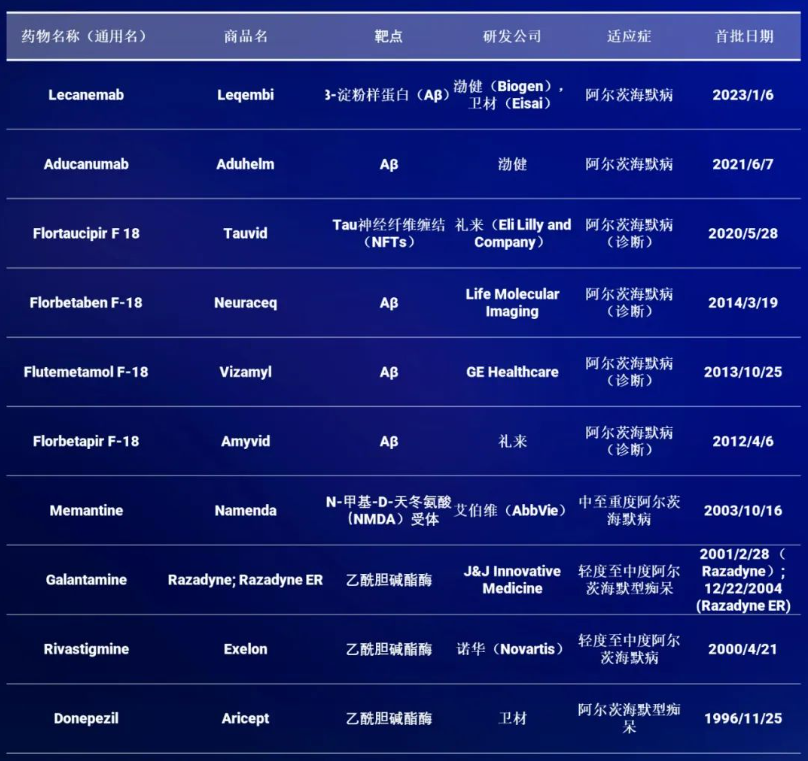
表1. 获得批准的AD代表药物
传统的小分子药物和抗体药物在一定程度上能够缓解症状,但由于AD的病因不清、病理过程复杂以及血脑屏障(BBB)的存在,传统药物的研发面临巨大挑战,这促使科学家们寻求新的治疗方法和策略。
基因治疗是一种新兴且功能强大的疾病治疗方法,目前在单基因罕见病治疗方面已取得了很大成功。鉴于基因治疗在近年来取得的显著成绩,人们期待AD也可以通过基因调节而得到有效治疗。目前已知25种基因可显著增加AD的患病风险。可见,基因治疗在AD治疗领域有望发挥重要角色。
近年来,对AD发病机制和通路的进一步了解为基因治疗的靶点识别提供了各种技术手段。目前已经确定了多个潜在的AD基因治疗靶点,针对这些基因治疗靶点近年来已初步开始探索和开启了多项临床试验(表2)。本文就这些潜在靶点和其开发情况做一个简要介绍。
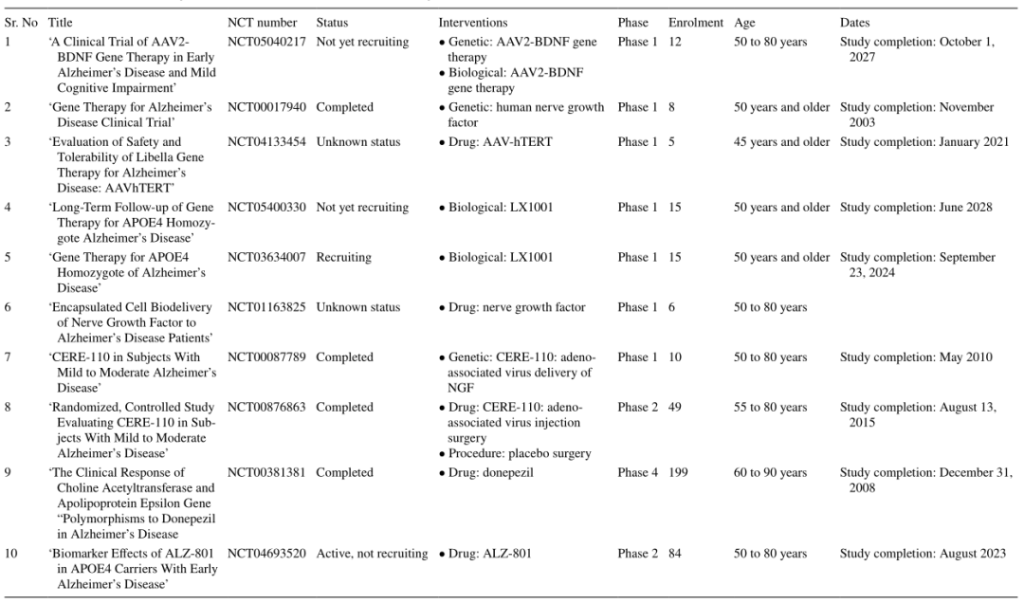
表2. 基因治疗AD的临床试验
神经营养因子(NGF)
神经营养因子(NGF)是一种内源性神经营养因子,对基底前脑胆碱能神经元的存活、连接性和突触可塑性至关重要,并与AD中神经元的退化有关。NGF对周围神经系统(交感神经和感觉神经)和中枢神经系统(胆碱能神经元)的生长、存活和功能具有重要作用。它通过激活TrkA受体参与调节基底前脑胆碱能神经元,并调节神经系统的发育。
最近的研究发现,NGF的缺乏会促进Aβ蛋白的产生,并与阿尔茨海默病中的Aβ蛋白连接有关。使用转基因小鼠模型的研究表明,NGF抗体的过表达会导致基底前脑胆碱能神经元的tau蛋白过度磷酸化,从而导致认知能力下降和神经退行性变。因此,NGF可能被用于治疗阿尔茨海默病,以加强胆碱能神经元并增加它们的活动,以弥补基底前脑乙酰胆碱水平的降低。
有趣的是,在使用NGF基因敲除小鼠进行的实验中,并未观察到基底前脑胆碱能神经元的问题,但对感觉神经和交感神经节的影响明显。然而,NGF能够阻止在唐氏综合征小鼠模型中基底前脑胆碱能神经元的远程运输障碍和退行性变,这表明NGF具有神经营养作用。在小鼠上进行的研究还发现,NGF的注入可以防止核基底内胆碱能神经元的退化,从而预防老龄小鼠记忆功能的衰退,改善了阿尔茨海默病中的胆碱能缺陷。
在进行了临床前试验后,一些患者接受了神经生长因子(NGF)的临床试验。由于NGF无法穿过血脑屏障,因此它通过脑室内注射给予患者。然而,这种方法出现了意外的不良反应,包括疼痛综合征、施万细胞的迁移和增殖,以及摄食减少。这是因为NGF在大脑中广泛且无法受控地分布,导致体重减轻。
然而,研究人员发现,当NGF以定位靶向的方式递送时,疼痛相关的副作用可以被消除。将NGF通过体外基因递送的方式传递到认知障碍灵长类动物的基底前脑,研究人员成功消除了疼痛相关的副作用。后来对猴子的研究发现,当NGF通过基因递送给细胞时,内侧隔脑胆碱能神经元并没有丧失。
基于这些发现,第一项临床试验使用成纤维细胞进行NGF基因递送,并且结果显示没有NGF相关的不良反应,并且明显减缓了认知退化。这种方法还可以更好地控制NGF在大脑中的分布和水平。因此,通过基因转移的方式递送NGF可能是一种更有效且副作用较少的治疗方法。
卡罗林斯卡研究所开始进行临床试验1b阶段,使用经过工程改造的视网膜上皮细胞表达NGF。在试验中,六名患者接受了半透性生物传递装置,释放NGF并防止细胞迁移,没有出现任何术后并发症。
脑源性神经营养因子(BDNF)
BDNF基因在大脑中广泛存在,特别是在大脑皮层和海马体的神经元中,对于记忆和学习至关重要。它通过激活受体TrkB和p75NTR来控制分化,并确保多巴胺能和乙酰胆碱能神经元的存活。
研究表明,BDNF与AD之间存在着遗传联系。在动物模型中,BDNF治疗改善了学习和记忆功能的损害。此外,AD小鼠模型中发现BDNF水平较低与神经毒性A寡聚体的含量较高相关。脑组织的尸检分析也显示,AD患者的颞叶皮层和海马体中BDNF水平较低。
BDNF的减少会导致BDNF-TrkB信号传导减弱,影响记忆。它还刺激了Aβ的合成,并增加了促炎细胞因子的产生,从而加剧AD的病理过程。此外,BDNF的中和或删除还会促进APP和Tau的裂解,并产生Aβ和神经毒性Tau N368。
为了发挥BDNF对AD的保护作用,需要将其递送到大脑中。由于BDNF的亲脂性有限且无法穿过血脑屏障,基因递送被认为是一种有益的治疗替代品。
研究表明,将BDNF基因转移到大脑的颞叶皮层可以修复空间记忆缺陷,并改善认知功能。在动物模型和灵长类动物中的实验中,BDNF基因治疗已显示出减少神经元损失、改善记忆和逆转突触退化的积极效果。
总之,这些发现支持了BDNF基因递送将是一种可行的AD治疗方法的策略。
Neprilysin
AD的两个主要原因是细胞内过度磷酸化tau蛋白的积累和Aβ肽的堆积。Aβ肽是通过酶分解淀粉样前体蛋白(APP)产生的,最常见的是由40个和42个氨基酸组成的肽。Aβ肽在大脑中的水平由APP产生速率、通过血脑屏障的转运速率和在脑实质中的降解速率三个因素决定。
Neprilysin是一种内源性蛋白酶,能有效降解Aβ肽。随着年龄增长,Neprilysin的水平会减少,而AD患者的脑组织中检测到的Neprilysin水平更低。
研究表明,增加大脑中的Neprilysin活性可能有助于防止Aβ肽在大脑中的积累,从而保护神经元免受Aβ的毒性影响,并预防与Aβ相关的认知障碍和突触退化。因此,Neprilysin基因递送可能是降低AD患者体内Aβ水平的有益治疗方法。
目前已经开发了用于递送Neprilysin的病毒载体,这些载体具有高转导率。先前的研究使用辛德比斯病毒载体成功降低了小鼠原代皮层神经元中的Aβ水平。另外,使用慢病毒载体递送Neprilysin基因给予APP转基因小鼠后,大脑的同侧斑块明显减少。此外,使用rAAV载体进行Neprilysin基因递送也能有效降解Aβ。
然而,使用病毒载体可能存在毒性、免疫原性问题,以及选择靶细胞的能力有限和成本增加等限制。一项腺病毒介导的基因治疗实验中出现了严重的免疫系统刺激,导致患者死亡。因此,在将这种策略用于AD临床试验之前,需要解决与Neprilysin水平上升相关的技术障碍和安全考虑。
Apolipoprotein E (APOE)
APOE基因编码的蛋白质在脂质代谢中起着重要作用,与AD的发展有关。人类有三种常见的APOE等位基因,分别是ε2、ε3和ε4,其中ε4等位基因在AD患者中的频率较高。APOE4等位基因与AD的风险增加有关,与Aβ的清除能力较弱相关。
研究表明,通过基因治疗引入APOE2等位基因可以改变淀粉样蛋白的发病机制,降低Aβ的浓度和沉积。APOE2与APOE3相比,与Aβ结合后更有效地促进Aβ通过BBB的清除。因此,基因递送APOE2可能是一种治疗AD的有效方法。
2022年2月,LEXEO Therapeutics公布LX1001在治疗APOE4纯合子AD患者的1/2期临床试验中获得积极数据。LX1001是一种基于AAV的在研基因疗法,旨在将表达保护性APOE2的转基因递送到携带两个APOE4等位基因的阿尔茨海默病患者的中枢神经系统(CNS),以阻止或减缓疾病进展。
初步结果显示,在所有随访时间超过3个月的患者中都观察到脑脊液中的APOE2蛋白表达。在随访时间超过12个月的两名患者中,脑脊液中的tau蛋白水平和磷酸化tau蛋白水平与基线相比降低。
此外,APOE基因治疗还可以通过调节胆固醇代谢来影响AD的发展。研究发现,APOE基因治疗可以增加脑内胆固醇的水平,从而影响神经可塑性和Aβ的代谢。基因递送APOE2还可以通过调节胆固醇-羟化酶的表达来改变脑内胆固醇的代谢,进一步降低Aβ的水平。
虽然APOE基因治疗在AD治疗中显示出潜力,但仍需要进一步的研究和临床试验来验证其安全性和疗效。此外,精确控制APOE2的表达是一个重要的挑战,以避免潜在的副作用。
内皮素转化酶(ECE)
ECE是一种锌金属蛋白酶,与Neprilysin类似,参与降解Aβ肽。ECE具有细胞外锌结合活性,主要底物是内皮素-1和内皮素-2,它们是强效血管收缩剂,定位在血管内皮细胞中。
ECE-1和ECE-2是两种类型的ECE。ECE-1在N末端侧切割Aβ肽的特定残基,对Aβ40和Aβ42的降解都有显著倾向。
研究表明,在AD脑中,ECE-1和ECE-2的水平严重受损。在下颞叶顶叶中,ECE-2的水平会显著降低。因此,ECE也被认为是潜在的AD治疗靶点。
Cathepsin B
像其他Aβ降解酶一样,Cathepsin B是另一种Aβ降解酶。当给小鼠注射 Cathepsin B抑制剂时,可以减少Aβ40、Aβ42和CTF-β水平。在过表达野生型APP的转基因小鼠中,它还改善了记忆缺陷。由于Cathepsin B存在于淀粉样斑块中,认为它与Aβ的代谢有关,但目前尚不清楚Cathepsin B如何影响Aβ的代谢。
已有研究表明,在APP转基因小鼠(J20)中,Cathepsin B缺乏会增加海马和大脑皮层中的斑块负荷和Aβ42/40比率。
此外,通过慢病毒进行Cathepsin B基因递送可以降低Aβ水平和硫代黄素S阳性淀粉样斑块,这表明Cathepsin B在Aβ降解中发挥了作用。
小结
自发现AD以来,科学家们在这个领域进行了广泛的研究,深入探究了AD的病理生理学以开发有效的治疗靶点。最初开发的传统药物并不能作为疾病修复性的解决方案而仅起到缓解症状的效果。基因治疗有望是治疗AD的一种高效选择。近年来,发现了许多基因治疗AD的靶点,临床前和临床试验中已显示出了积极的结果。然而,基因治疗AD仍尚处于早期阶段,其强大疗效依然有待探索和开发,发展历程也将充满挑战,但相信其终将为AD的治疗带来新希望和新突破。