前列腺癌是全球男性中第二常见的恶性肿瘤,转移性去势抵抗性前列腺癌(mCRPC)更是其一种极具侵袭性的晚期阶段,以雄激素受体(AR)表达增加和信号传导增强为特征。尽管现有治疗手段如AR信号通路抑制剂(ARPIs)在一定程度上延缓了疾病进展,但多数患者最终仍会对其产生耐药性。

近日,J. Med. Chem.期刊上公布了一篇名为“RIPTACs for Precision Cancer Therapy: A Novel Modality with the Inspiration of HLD-0915 as the First Candidate in Clinical Trials”的文章,描述了一种新型的癌症治疗模式——调节诱导近邻靶向嵌合体(RIPTACs),特别是HLD-0915,这款首个进入临床试验的候选药物作为一种新型癌症治疗策略的潜力和前景。
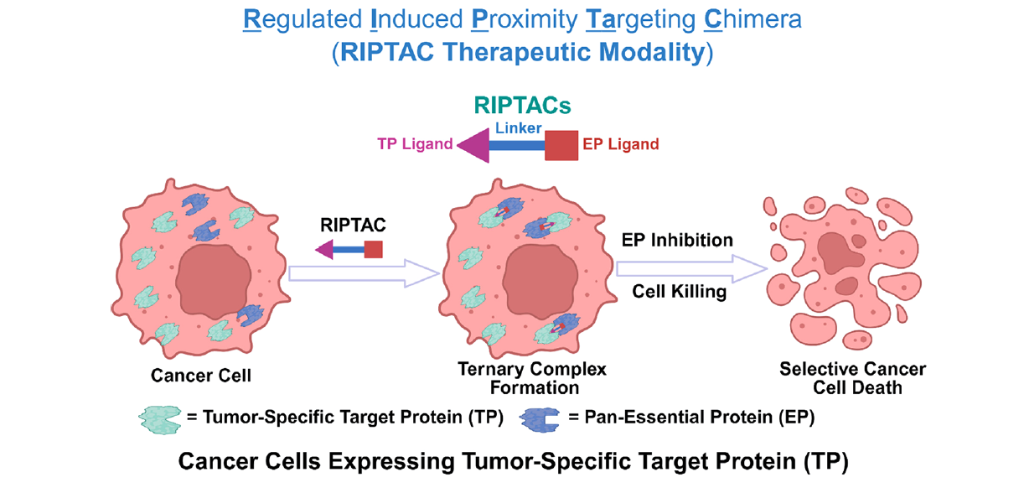
RIPTACs的设计原理和作用机制
(1)结构组成:RIPTACs是一类异双功能分子,包含一个针对肿瘤特异性靶蛋白(TP)的配体、一个针对泛必需蛋白(EP)的配体以及连接这两个配体的连接链。TP在癌细胞中特异性表达,而EP对细胞生存至关重要。
(2)作用机制:RIPTACs在表达肿瘤特异性TP的癌细胞中选择性积累,并与TP和EP形成稳定的三元复合物(TP:RIPTAC:EP)。这种复合物的形成增强了TP和EP之间的蛋白质-蛋白质相互作用(PPIs),从而抑制EP的功能,导致癌细胞的选择性死亡,而对非TP表达的健康细胞无影响。
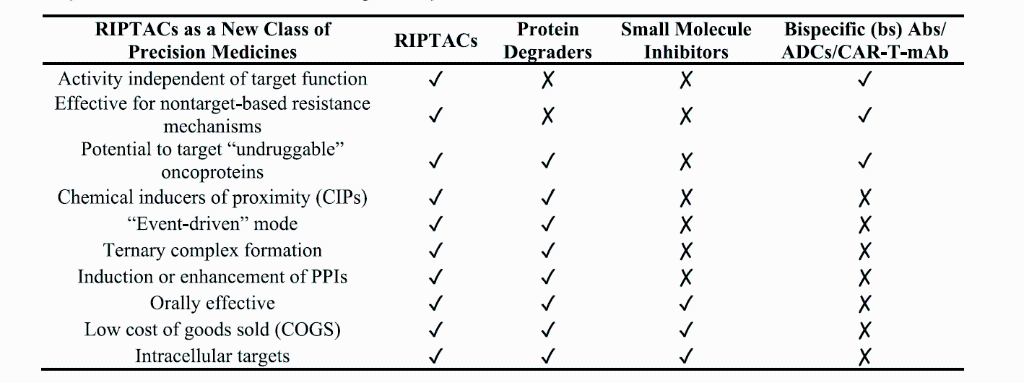
上图对比了 RIPTACs 与其他癌症治疗模式的关键特性:RIPTACs 通过诱导 TP 和 EP 之间的近邻关系,形成三元复合物,抑制 EP 功能,实现选择性杀伤癌细胞。与小分子抑制剂和蛋白降解剂不同,RIPTACs 的作用不依赖于 TP 功能,且对非靶点抗性机制有效,能够靶向“不可成药”蛋白。与双特异性抗体(bsAbs)、抗体-药物偶联物(ADCs)和 CAR-T-mAb 相比,RIPTACs 可以口服,且靶向细胞内 TP。
代表性药物HLD-0915的临床研究
HLD-0915是一种针对雄激素受体(AR)的RIPTAC,这是一种新型的口服前列腺癌治疗药物,由Halda Therapeutics开发。它是首个进入临床试验的RIPTAC,目前正在进行 1 期临床试验(NCT06800313),用于治疗转移性去势抵抗性前列腺癌(mCRPC)。
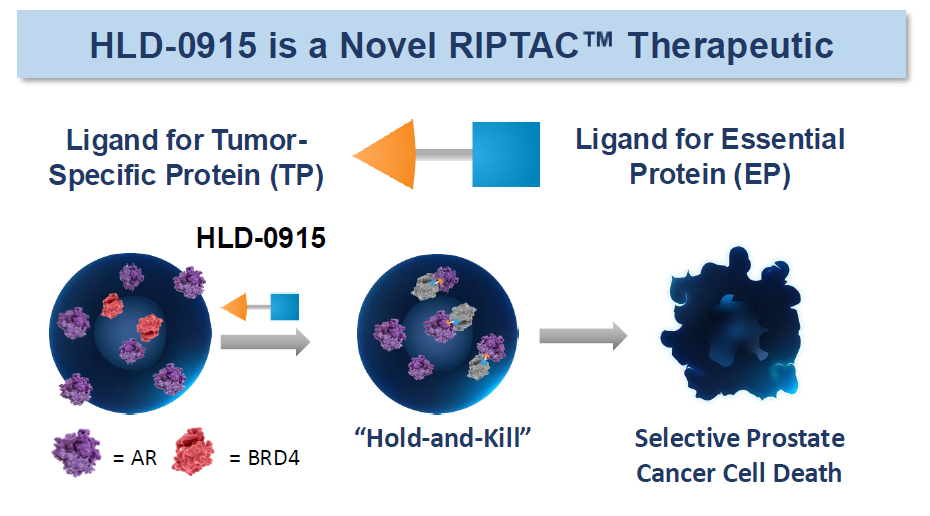
HLD-0915的作用机制:
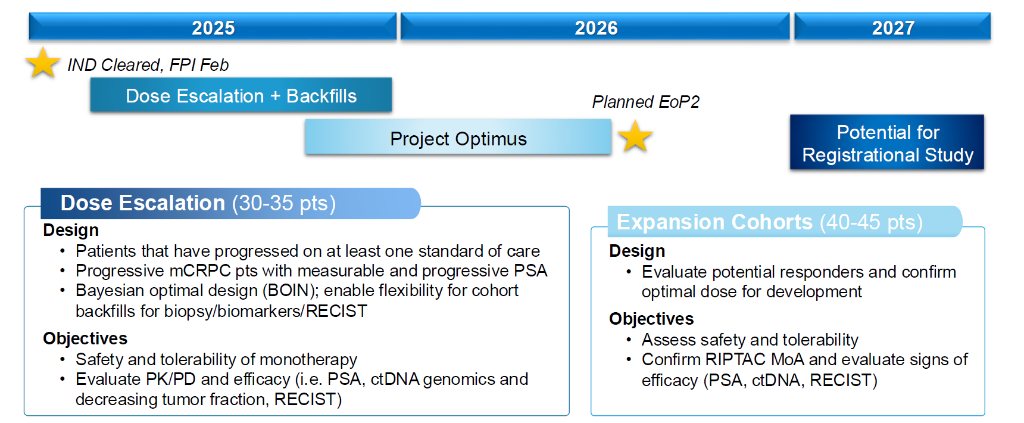
该临床研究旨在评估HLD-0915的安全性、耐受性、药代动力学(PK)、药效学(PD)以及抗肿瘤活性。试验分为两个阶段:第一阶段为剂量递增研究,以确定HLD-0915的最大耐受剂量(MTD)和/或推荐剂量;第二阶段扩展队列旨在进一步评估HLD-0915的疗效和安全性。
研究计划招募多达80名mCRPC患者。 1 期试验采用BOIN设计,每个剂量组至少有 3 名患者。尽管HLD-0915的EP和化学结构尚未公开,但其在临床前前列腺癌模型中表现出显著的肿瘤缩小和前列腺特异性抗原(PSA)降低,同时具有良好的治疗指数。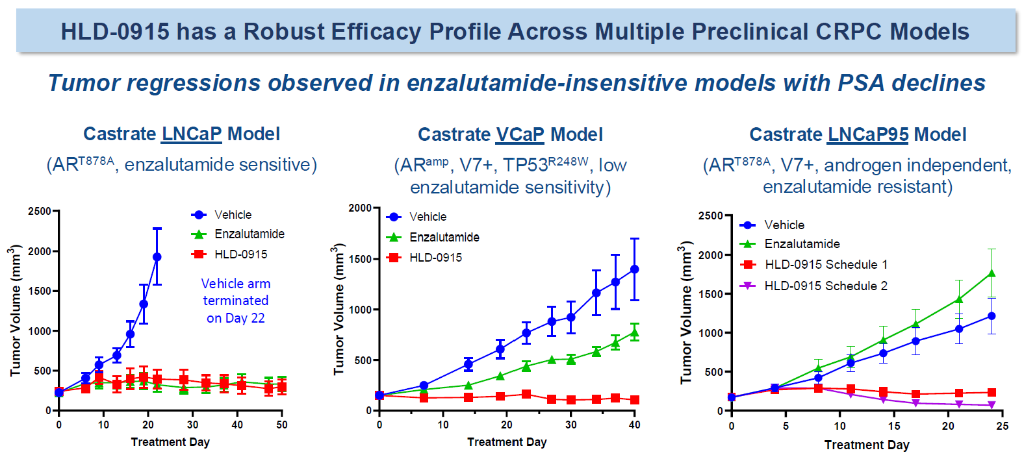
HLD-0915 的临床开发策略:2025 年在 mCRPC 中进行 1 期试验,乳腺癌的 IND(Investigational New Drug,新药临床试验申请)正在进行中,以及针对新肿瘤类型的产品线开发,同时也在探索超越肿瘤学的广泛平台。
结语
RIPTAC技术作为一种新型的化学诱导近邻治疗策略,为创新药物发现和开发开辟了新途径。RIPTACs具有独特的选择性和广泛的适用性,能够减轻包括靶向非肿瘤毒性在内的副作用,并克服药物抗性。